Difficultés
Les méthodes classiques d’extraction d’ADN génomique font intervenir de nombreux produits chimiques dont certains sont dangereux ou difficiles à manipuler (phénol, chloroforme…), ainsi qu’un appareillage spécifique (centrifugeuse réfrigérée).
En général, le chercheur ne peut se soustraire à ces protocoles en raison notamment de la relative pauvreté des tissus animaux ou végétaux sur lesquels il travaille. Les techniques utilisées doivent donc assurer un rendement maximal, d’autant qu’au cours des multiples étapes de purification, une proportion non négligeable de l’ADN est perdue.
Dans le cadre de nos enseignements (partie "Diversité et unité des êtres humains" du programme de troisième, et partie "Cellule, ADN et unité du vivant" du programme de seconde) nous pouvons utiliser une méthode simple permettant de visualiser facilement les filaments d’ADN.
Il faut au préalable choisir un matériel largement disponible et possédant une richesse en ADN exceptionnelle. Le chou-fleur répond à ces critères.
Pourquoi le chou-fleur ?
Cette plante est un mutant de la floraison du chou fourrager.
Chez le chou fourrager (et la plupart des Brassicacées), il y a formation d’une rosette de feuilles basale entretenue par l’activité d’un méristème végétatif terminal. A la suite de l’induction florale, ce méristème végétatif subit une transition vers un méristème inflorescentiel, puis vers un méristème floral.
Alors que la croissance du méristème floral est finie, méristèmes végétatifs et inflorescentiels ont un fonctionnement théoriquement infini.
Chez le chou-fleur, la transition méristème inflorescentiel - méristème floral est bloquée et des axes inflorescentiels, qui restent très compacts, remplacent les fleurs.
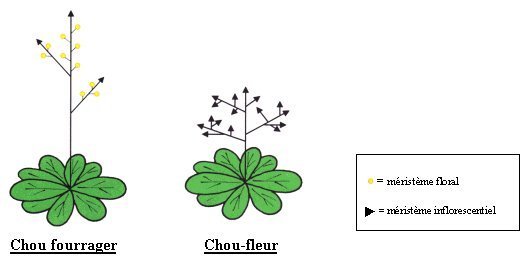
On peut donc parler de mutant homéotique puisqu’il y a développement d’un organe normal (une inflorescence) à la place d’un autre organe (une inflorescence à la place d’une fleur). Cela se traduit par une prolifération de méristèmes inflorescentiels à la base desquels d’autres méristèmes inflorescentiels portent encore des méristèmes d’inflorescences … constituant la pomme du chou-fleur. Or, les cellules méristématiques, en raison de leur état indifférencié, possèdent un rapport nucléoplasmatique très élevé. La quantité d’ADN par unité de masse y sera donc très importante. De plus, les cellules méristématiques sont bordées de parois primaires minces, facile à déchirer au broyage, et l’absence de pigmentation ou de chlorophylle facilitera l’observation.
Protocole d’extraction
– Dans un mortier broyer à peu près 10 g d’extrémités de la pomme du chou-fleur.
– Rajouter une bonne pincée (environ 2 g) de gros sel et finir le broyage jusqu’à l’obtention d’un mélange pâteux homogène.
– Mettre le broyat dans un morceau de gaze (10 x 10 cm) ; bien presser sur le sachet de gaze pour en faire sortir 1 à 2 mL de filtrat qui sera collecté, grâce à un entonnoir, dans un tube à essai.
– Rajouter au moins 2 volumes d’éthanol (ou d’alcool à brûler) dans le tube à essai ; agiter légèrement et laisser remonter le précipité blanc d’ADN vers la surface du tube.
– Recueillir l’ADN en l’enroulant au bout d’une pipette Pasteur et le déposer dans un verre de montre contenant le vert de méthyle acétique ; tapoter avec l’agitateur en verre ; laisser colorer quelques secondes.
– Avec la pince fine déplacer la masse d’ADN dans un deuxième verre de montre contenant de l’eau. Rincer si nécessaire une nouvelle fois jusqu’à ce que l’eau soit limpide.
Résultat
L’ADN est alors coloré en vert (à mettre en parallèle avec la coloration par le même colorant des noyaux de cellules d’épiderme d’oignon).
Précautions
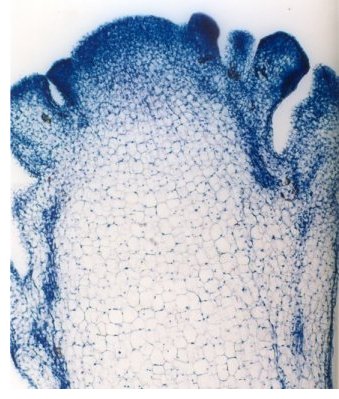
Comme le montre l’image ci-dessous, au sein de la pomme du chou-fleur, les cellules méristématiques sont périphériques. Il convient donc de prélever plus particulièrement les extrémités de la pomme et de les broyer dans un mortier, en présence de chlorure de sodium en excès. Le gros sel de cuisine convient très bien car il facilite le broyage par effet abrasif.
On peut aussi utiliser un mixer, à condition que le broyage soit assez fin pour obtenir une consistance pâteuse. Le broyat est ensuite grossièrement filtré sur de la gaze.
En raison de la grande viscosité du liquide contenu dans le broyat, il est impossible de filtrer sur du papier filtre et il est même indispensable de bien presser sur le sachet de gaze pour en faire sortir le liquide qui sera collecté dans un tube à essai.
Le sel est indispensable à la précipitation de l’ADN qui reste insoluble dans l’éthanol. Une agitation très légère du tube, ainsi qu’un léger dégagement gazeux (probablement les gaz emprisonnés dans le filtrat ?), permettent, en quelques dizaines de secondes, la remontée de la "méduse" d’ADN vers la surface du tube.
On peut, si nécessaire, retourner délicatement 2 ou 3 fois le tube bouché pour mélanger son contenu (mais sans secouer violemment le tube, car les filaments d’ADN se brisent, ce qui rend leur récupération problématique).
On obtient une masse blanchâtre, facile à récupérer à l’extrémité d’une pipette Pasteur, que l’on peut sortir du tube. La masse d’ADN recueillie peut être colorée par un colorant acidophile, tel le vert de méthyle acétique.
Validité de la méthode
S’agit-il bien d’ADN recueilli à la surface du tube ?
Il est possible de le démontrer si l’on réalise l’électrophorèse de l’ADN obtenu.
La pelote d’ADN (non colorée !) est laissée à l’air libre à la pointe de la pipette Pasteur pendant une dizaine de minutes pour laisser s’évaporer l’éthanol puis est solubilisée dans un tampon aqueux.
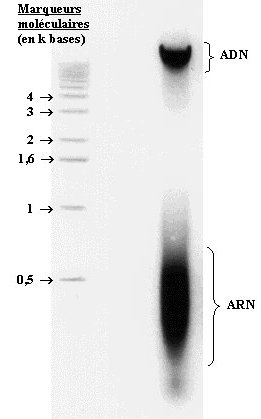
La solution obtenue peut être chargée sur gel d’agarose et les molécules se séparent suivant leur taille. La coloration au bromure d’éthydium (BET), spécifique des acides nucléiques, révèle en fait deux "bandes".
- La première "bande" de masse moléculaire élevée (> 6 kbases) correspond à la taille attendue des fragments d’ADN.
- La deuxième "bande" révèle l’ARN, de masse moléculaire inférieure à 400 bases.
D’ailleurs, un traitement de 30 min à 37°C par la RNase avant chargement sur gel provoque la disparition de cette bande.
Ce profil électrophorétique montre donc que l’extraction de l’ADN est couplée à celle de l’ARN. Cependant cette extraction reste peu sélective. En effet de nombreuses protéines (protéines régulatrices, histones) restent associées à l’ADN et lui donnent sa couleur blanchâtre dans l’éthanol. D’ailleurs, le test de Biuret, réalisée sur la masse d’ADN recueillie, est positif. Pour une purification plus complète, une déprotéinisation serait alors nécessaire, par lavage au phénol/chloroforme ou par traitement enzymatique.
Autres essais
| Organisme | Organe | Résultat |
| Chou-fleur | extrémités de la pomme | +++ |
| pomme entière | +++ | |
| pomme - extrémités | + | |
| côtes des feuilles | + | |
| Oignon blanc | bulbe entier | +++ (1) |
| Oignon jaune | bulbe entier | +++ (1) |
| Ail | bulbe entier | +++ (1) |
| Haricots cocos blancs (2) | graines | ++ (1) |
| Pomme de terre | tubercule | 0 |
| Navet long | racine | 0 |
| Navet rond | racine | 0 |


