Présentation et pistes d’exploitation de modèles moléculaires spécialement conçus pour l’enseignement par l’équipe de Anne HOUDUSSE à l’Institut Curie.
Auteur : Vincent GUILI, Lycée Descartes, Saint-Genis-Laval
Liens avec le BO
BO spécial n°8 du 25 juillet 2019
Terminale spécialité : Corps humain et santé
Produire le mouvement : contraction musculaire et apport d’énergie
La cellule musculaire : une structure spécialisée permettant son propre raccourcissement
Connaissances
La cellule musculaire, cellule spécialisée, est caractérisée par un cytosquelette particulier (actine et myosine) permettant le raccourcissement de la cellule.
Capacités, attitudes
Utiliser un logiciel de modélisation moléculaire pour observer le pivotement des têtes de myosine.
Cadre de connaissances
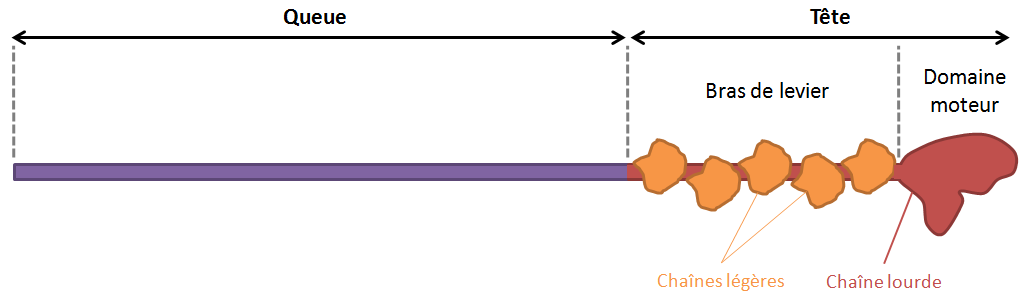
Les myosines forment une superfamille de moteurs moléculaires qui convertissent l’énergie chimique de l’hydrolyse de l’ATP en mouvement dirigé le long de la protéine filamenteuse qu’est l’actine. L’organisation des myosines est représentée schématiquement sur la figure 1.
Figure 1 : Structure schématique d’une myosine
Le domaine moteur contient le site de liaison à l’actine ainsi que le site actif qui lie et hydrolyse l’ATP. Il est suivi du bras de levier, région allongée de longueur variable selon les myosines. Le rôle principal du bras de levier est d’amplifier les changements conformationnels qui se produisent dans le domaine moteur pendant la production de la force. La région de la queue est également de longueur et de composition structurelle variables selon les myosines et joue un rôle essentiel dans l’assemblage des myosines entre elles.
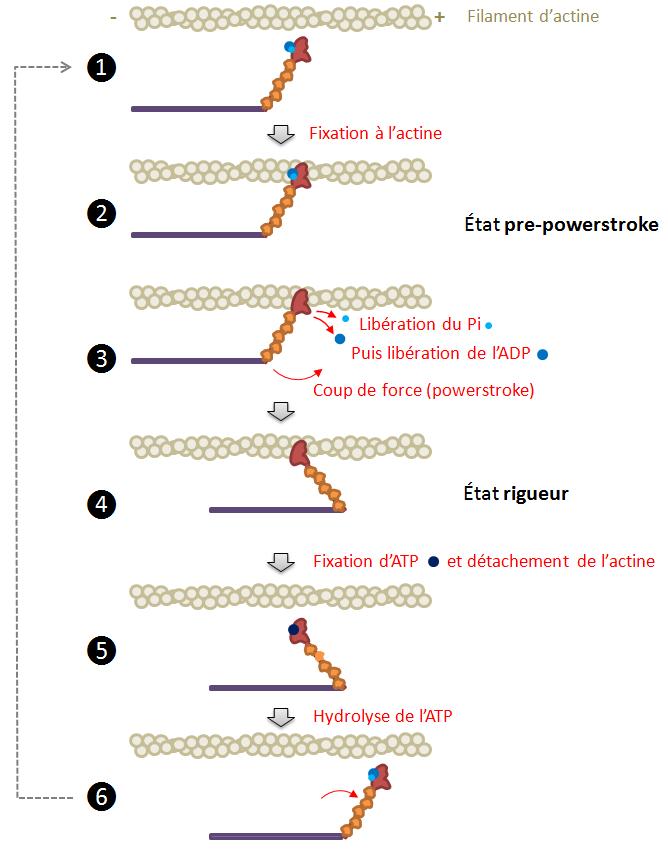
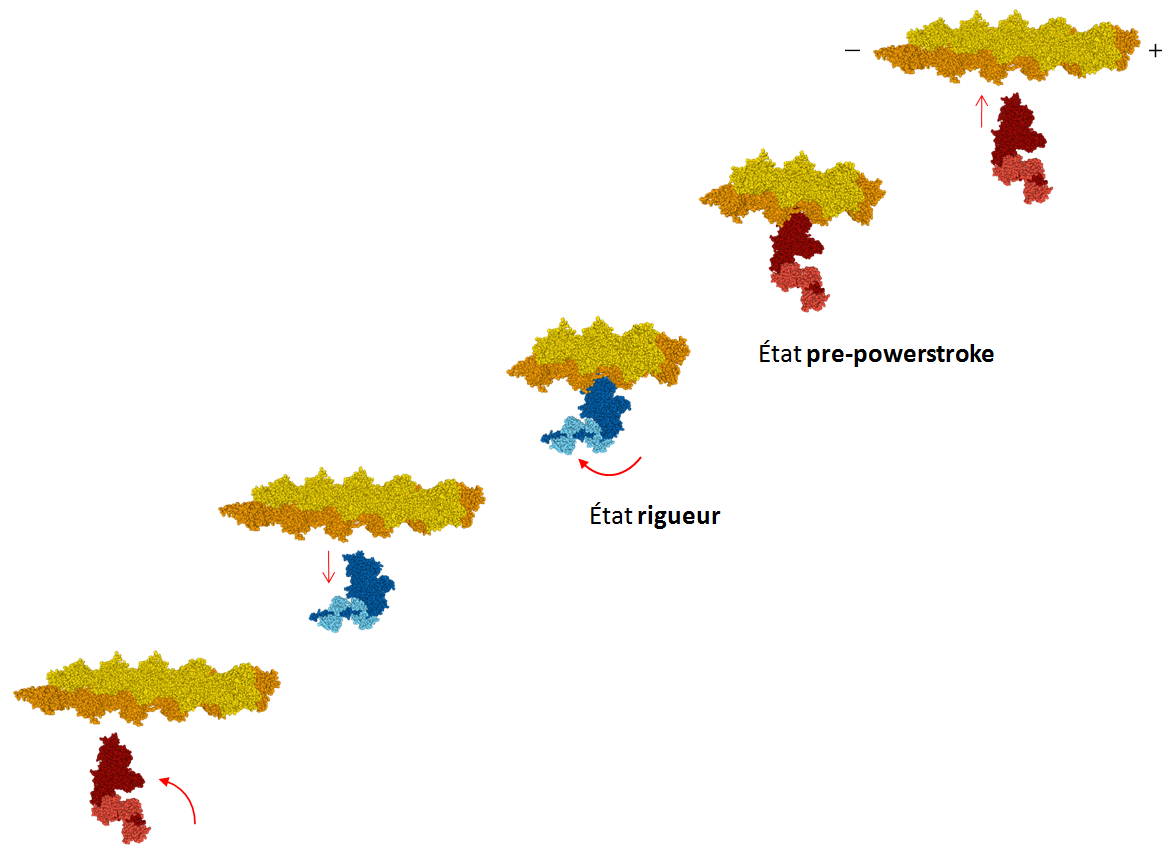
Le cycle des étapes moléculaires du mouvement de la myosine le long du filament d’actine est représenté sur la figure 2. À l’exception de la myosine 6, toutes les myosines se déplacent vers l’extrémité + du filament d’actine.
Figure 2 : Schéma simplifié des étapes du cycle de déplacement de la myosine le long du filament d’actine.
Descriptif des modèles
Les modélisations moléculaires proposées sur cette page ont été très aimablement conçues et mises à disposition en septembre 2020 par Carlos KIKUTI, ingénieur de recherche, et Anne HOUDUSSE, directrice de recherche, de l’Équipe Motilité Structurale, UMR144 - CNRS/Institut Curie. Ils ont également bien voulu relire la présentation qui en est effectuée ici et les pistes d’exploitation proposées.
Qu’ils en soient très vivement remerciés.
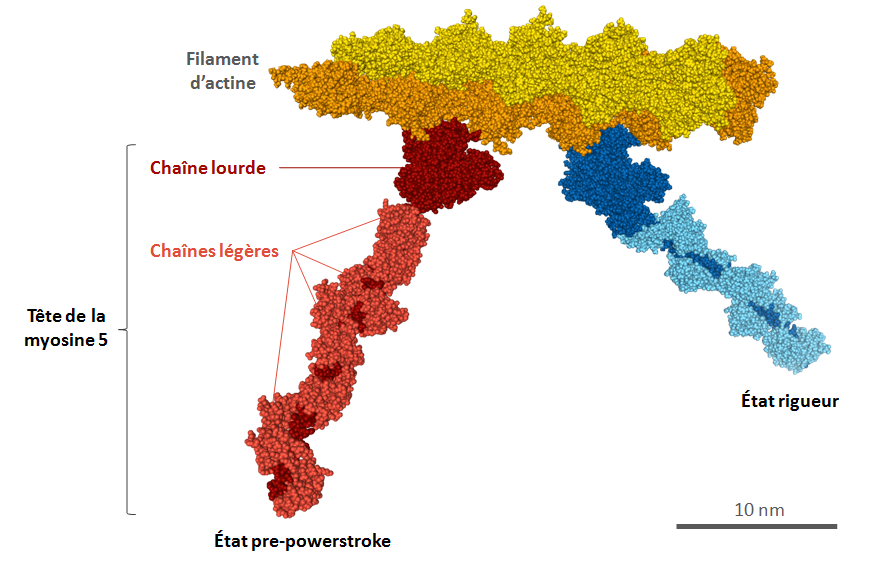
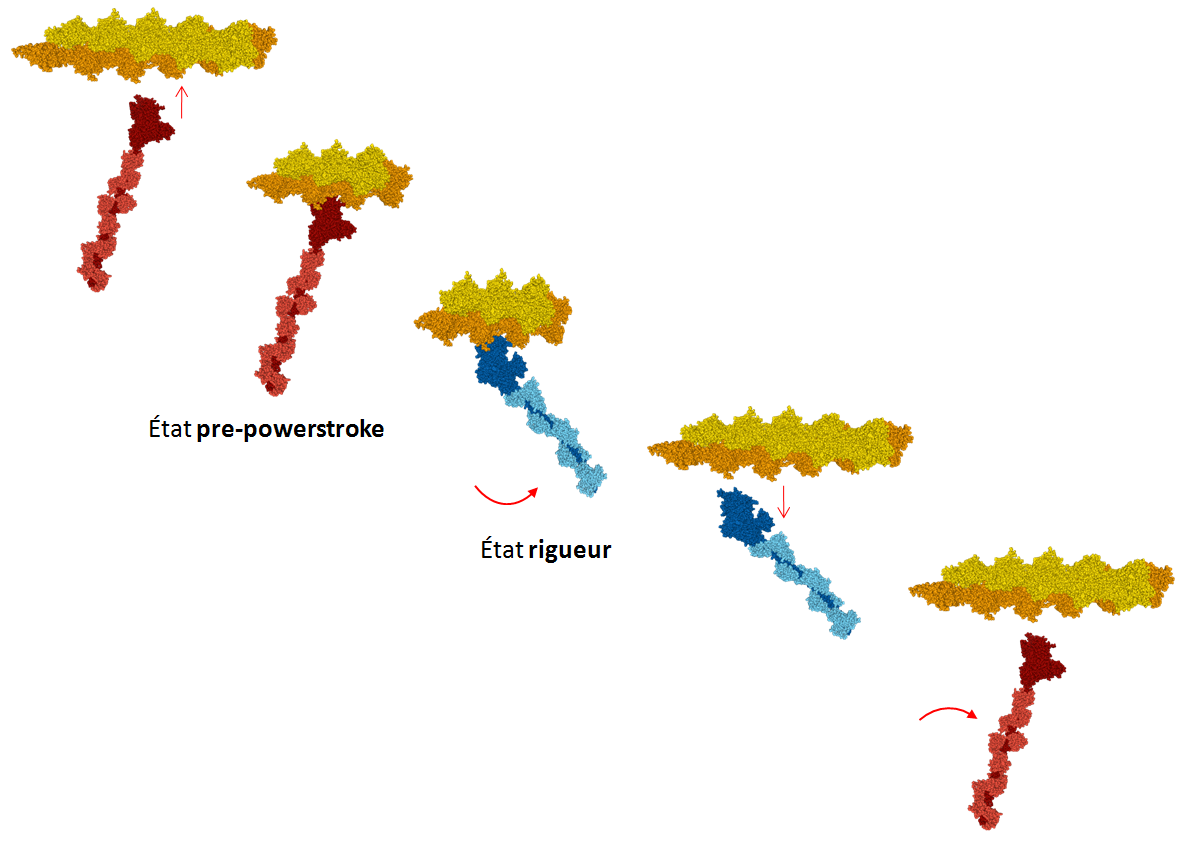
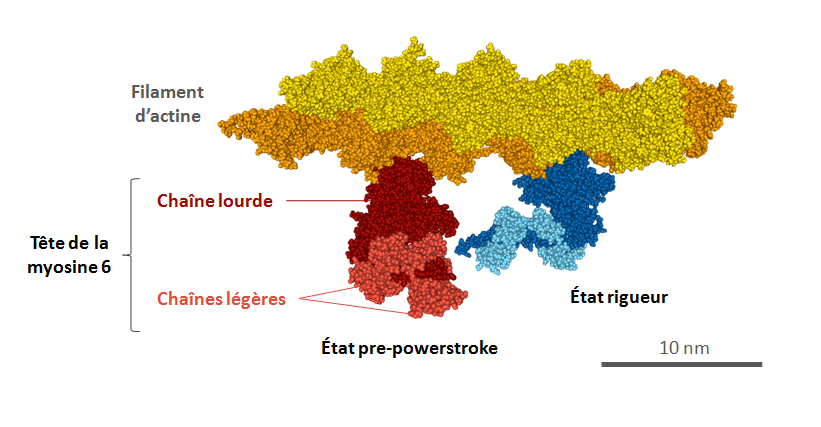
Deux modèles sont proposés : un de la myosine V, l’autre de la myosine VI, les deux protéines étant associées au filament d’actine. Dans les deux cas, seule la tête est présente, sans la queue. Pour chaque myosine, deux états sont présentés sur le même modèle : l’état pre-powerstroke, avant le mouvement, et l’état rigueur, après le mouvement.
Il ne s’agit pas de myosines de muscles, mais leur structure et leur fonctionnement sont assez semblables à ceux de la myosine II qu’on trouve dans les sarcomères.
Les différentes conformations du domaine moteur de chaque myosine ont été résolues par cristallographie de rayons-X. L’interaction de la myosine (en état rigueur, ou post-powerstroke) avec le filament d’actine et la structure du filament d’actine ont été décrites par cryo-microscopie électronique.
Fichier myo5_rigor_pps.pdb
- Chaîne A : chaîne lourde de la Myosine V en état rigueur (domaine moteur obtenu avec le pdb 1OE9, bras de levier modélisé à partir du pdb 2DFS).
- Chaînes B C D E F G : chaînes légères de la Myosine V en état rigueur, réorientées d’après le pdb 2DFS de façon à suivre l’inclinaison du bras de levier.
- Chaîne H : chaîne lourde de la Myosine V en état pre-powerstroke (domaine moteur obtenu avec le pdb 5HMP, bras de levier modélisé à partir du pdb 2DFS).
- Chaînes I J K L M Z : chaînes légères de la Myosine V en état pre-powerstroke, positionnées sur le bras de levier selon le pdb 2DFS.
- Chaînes N O P Q R S T U V W X Y : filament d’actine dont la structure a été résolue en présence de myosine V (Wulf et al., 2016 - Force-producing ADP state of myosin bound to actin. PNAS). La matrice de symétrie décrite dans le fichier pdb a été appliquée pour pouvoir visualiser sept protomères d’actine supplémentaires aux trois présents dans le fichier pdb d’origine.
Fichier myo6_rigor_pps.pdb
- Chaîne A : chaine lourde de la Myosine VI en état rigueur (domaine moteur obtenu avec le pdb 2BKH, bras de levier modélisé à partir du pdb 3GN4).
- Chaîne B : première chaîne légère de la Myosine VI en état rigueur, obtenue avec le pdb 2BKH.
- Chaîne C : deuxième chaîne légère de la Myosine VI en état rigueur, obtenue avec le pdb 3GN4.
- Chaîne D : chaine lourde de la Myosine VI en état pre-powerstroke (domaine moteur obtenu avec le pdb 4ANJ, bras de levier modélisé à partir du pdb 3GN4.
- Chaînes E F : chaînes légères de la Myosine VI en état pre-powerstroke modélisées à partir du pdb 3GN4.
- Chaînes N O P Q R S T U V W X Y : filament d’actine dont la structure a été résolue en présence de myosine VI (Gurel et al., 2017 - Cryo-EM structures reveal specialization at the myosin VI-actin interface and a mechanism of force sensitivity. Elife). La matrice de symétrie décrite dans le fichier pdb a été appliquée pour pouvoir visualiser sept protomères d’actine supplémentaires aux trois présents dans le fichier pdb d’origine.
Visualisation du modèle de myosine V et reconstitution du mouvement
Toutes les images ont été obtenues avec LibMol.
Figure 3 : Vue d’ensemble du modèle myo5_rigor_pps.pdb
La tête de myosine en état rigueur paraît plus petite. En réalité il n’en est rien, cela est dû au fait que les myosines ne sont pas dans le même plan et que sur cette capture d’image, la myosine en état rigueur part vers l’arrière.
Il est important de noter que les fichiers pdb sont ouverts dans des orientations différentes selon le logiciel utilisé. Il donc conseillé de repérer l’orientation du filament d’actine : on parle de bout (+) (=“barbed end”) et bout (-) (=“pointed end”). Le bout (+) est là où se trouvent les N- et C-termini de l’actine.
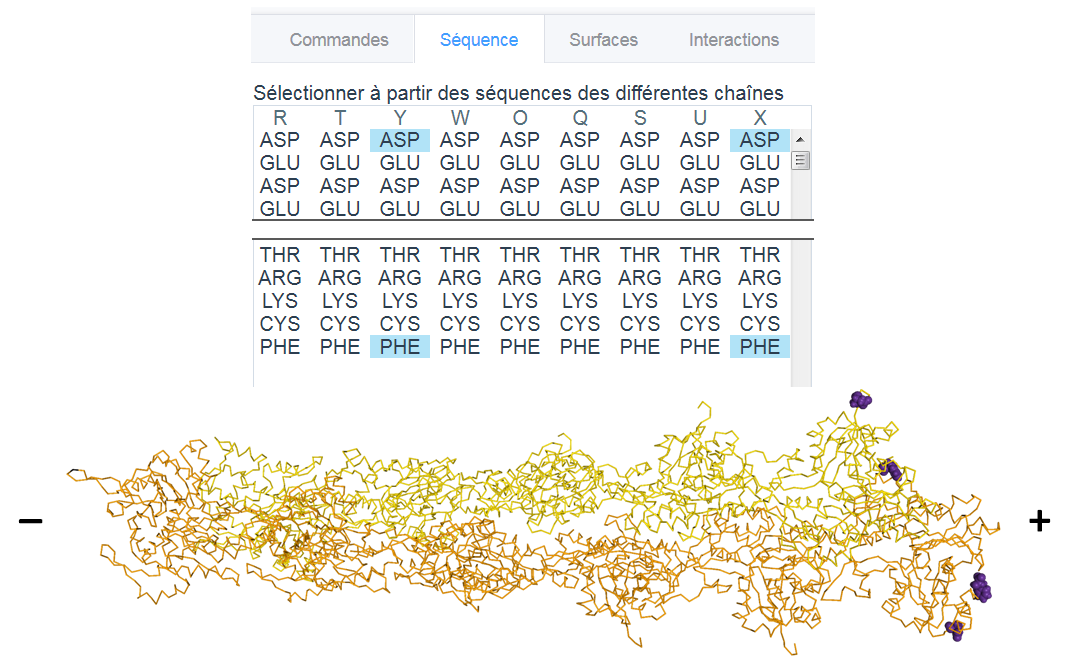
En mettant en exergue les premiers et derniers acides aminés des chaines d’actine X et Y (figure 4), il est possible d’orienter le modèle de telle sorte que le bout (+) soit affiché à droite. On verra alors sur la gauche la myosine en état pre-powerstroke, et sur la droite en état rigueur, comme sur la figure 3.
Figure 4 : Orientation du filament d’actine
Les premiers et derniers acides aminés des protomères d’actine pointent du côté +.
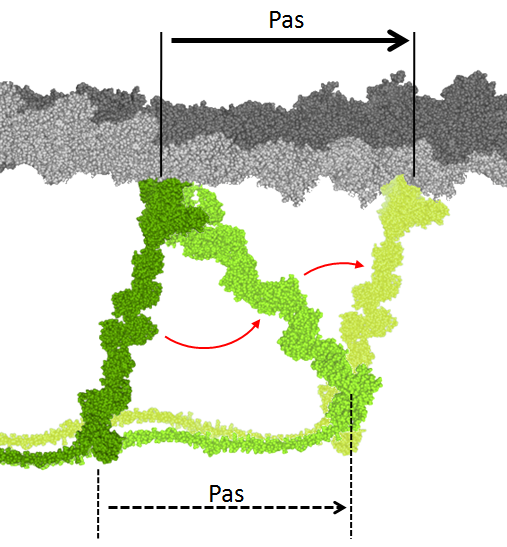
En choisissant de ne visualiser que certaines chaînes du modèle, on peut reconstituer les différentes étapes du cycle de déplacement de la myosine le long du filament d’actine (figure 5).
Figure 5 : Illustration des différentes étapes du cycle de déplacement de la myosine 5 le long du filament d’actine.


Mesures du mouvement de la myosine V sur le filament d’actine
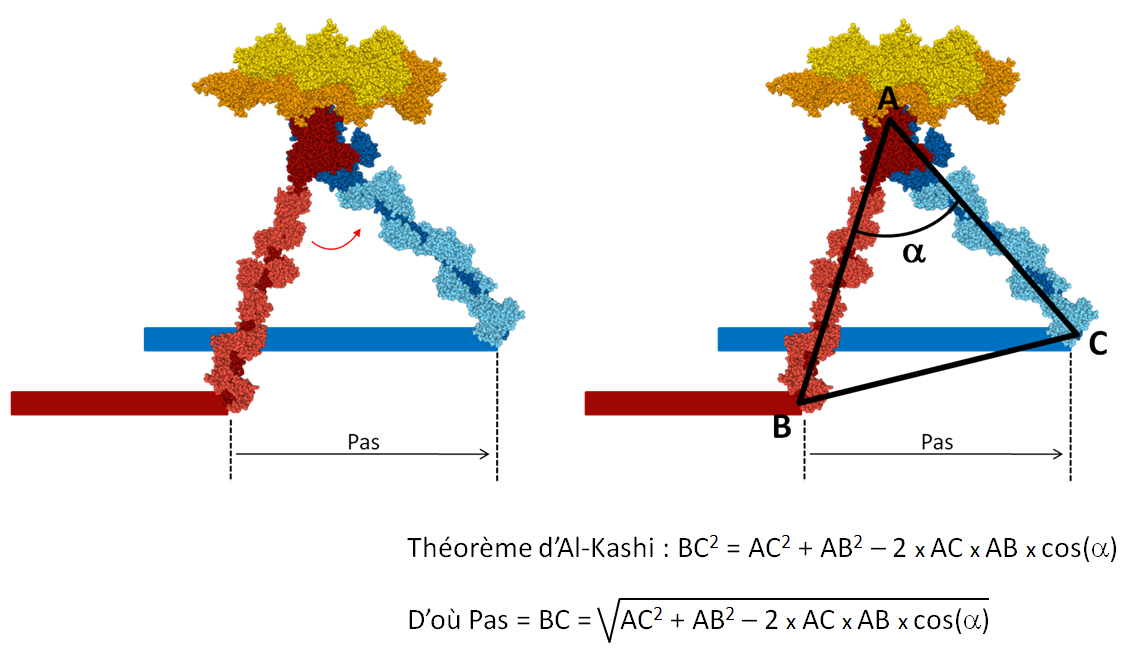
La tête de myosine se déplace le long du filament d’actine. À chaque cycle elle avance d’une distance appelée "pas". En utilisant le modèle, il est possible de calculer le pas (figure 6).
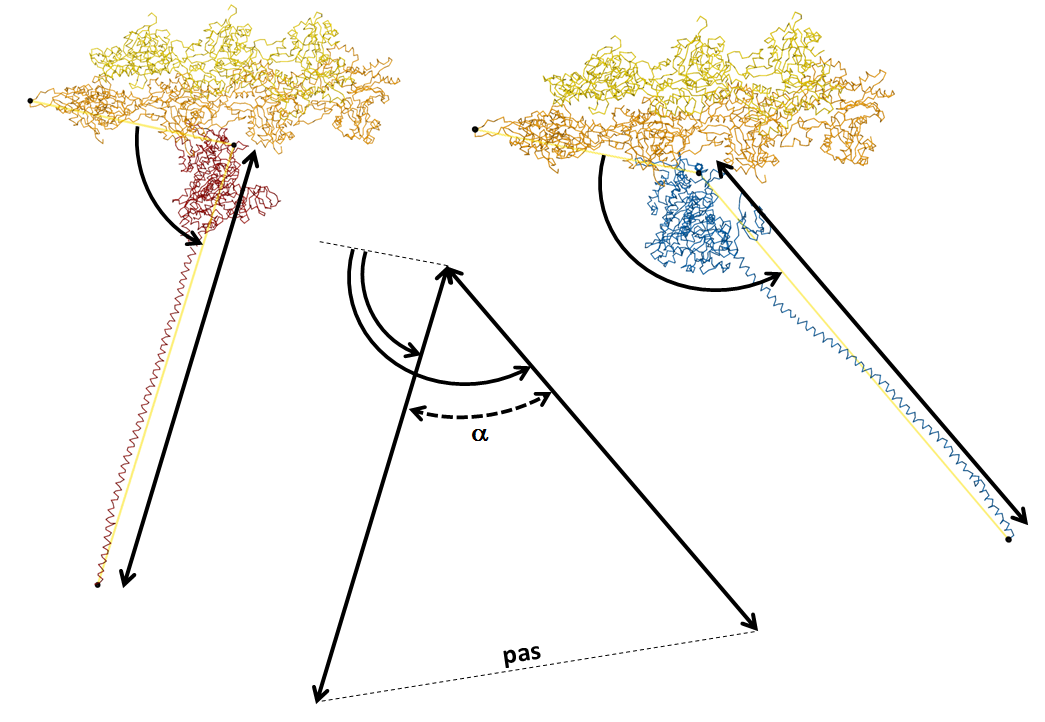
L’angle alpha n’est pas directement accessible, mais il peut-être obtenu à partir des mesures de l’angle du bras de levier avec le filament d’actine dans les deux états pre-powerstroke et rigueur. Afin d’être précis dans ces mesures, il est proposé de prendre comme points de repères les carbones alpha d’acides aminés situés aux extrémités des protéines myosine et actine, comme indiqué sur la figure 7.
Figure 7 : Mesure des longueurs des bras de levier et des angles formés avec le filament d’actine.
Les acides aminés choisis sont le n°45 du protomère d’actine situé après celui sur lequel est fixé la myosine, ainsi que les acides aminés n°531 et 909 de la chaîne lourde de myosine V. Pour faciliter la mesure, seul le carbone alpha (CA) de ces acides aminés est figuré en sphère noire, le reste des molécules étant figuré en squelette.

Le tableau suivant donne les résultats de mesure :
|
État de la myosine |
Commande de sélection |
Mesures |
|
Pre-powerstroke |
.ca and (909:H 531:H 45:N) |
angle : 85° ; longueur 28,38 nm |
|
Rigueur |
.ca and (909:A 531:A 45:R) |
angle : 141,2° ; longueur 26,63 nm |