Mise en évidence de la présence de tanins dans les écorces des végétaux et démonstration expérimentale de leurs effets antibactériens (bactéricides).
Auteure : Catherine MEILLAUD, lycée La Martinière Duchère, Lyon
Liens avec le BO
BO spécial n°8 du 25 juillet 2019
Terminale spécialité : Enjeux planétaires contemporains
De la plante sauvage à la plante domestiquée
La plante, productrice de matière organique
Les parties aériennes de la plante sont les lieux de production de matière organique par photosynthèse. Captée par les pigments chlorophylliens au niveau du chloroplaste, l’énergie lumineuse est convertie en énergie chimique par la photolyse de l’eau, avec libération d’O2 et réduction du CO2 aboutissant à la production de glucose et d’autres sucres solubles. Ceux-ci circulent dans tous les organes de la plante où ils sont métabolisés, grâce à des enzymes variées, en produits assurant les différentes fonctions biologiques dont :
- la croissance et le port de la plante (cellulose, lignine) ;
- le stockage de la matière organique (saccharose, amidon, protéines, lipides) sous forme de réserves dans différents organes, qui permet notamment de résister aux conditions défavorables ou d’assurer la reproduction ;
- les interactions mutualistes ou compétitives avec d’autres espèces (anthocyanes, tanins).
Motivation
Les communautés locales du nord-est du Brésil ont l’habitude d’utiliser l’écorce de certains arbres tels (Commiphora leptophloeos) pour soigner les infections bactériennes.
On cherche à comprendre ce qui dans l’écorce des arbres permet de soigner les infections bactériennes.

Objectif
mettre en évidence la présence de tanin dans les écorces des végétaux et montrer que ces tanins ont des effets antibactériens (bactéricides)
Compétences
- Concevoir, créer, réaliser : Concevoir et mettre en œuvre un protocole (possible)
- Pratiquer des démarches scientifiques : interpréter des résultats et en tirer des conclusions (évaluer ici)
- Adopter un comportement éthique et responsable : Participer à l’élaboration de règles de sécurité et les appliquer au laboratoire et sur le terrain. (évalué ici)
Matériel
- Écorce de tige de jeune chêne, de rosier, peau des fruits : grenade, fruit de la passion
- Perchlorure de fer à 5%
- Éthanol
- Eau distillée
Manipulation
Mise en évidence de la présence de tanins
Par précipitation (très facile, très visuel)
- Récupérer l’écorce d’une tige jeune ou d’un fruit (pour une tige, sur environ 10 cm de longueur)
- Faire bouillir de l’eau puis faire infuser l’écorce dans cette eau en laissant refroidir
- Ou faire bouillir les écorces quelques minutes, puis laisser refroidir.
- Filtrer dans une passoire pour éliminer les « morceaux »
- Ajouter quelques gouttes de perchlorure de fer
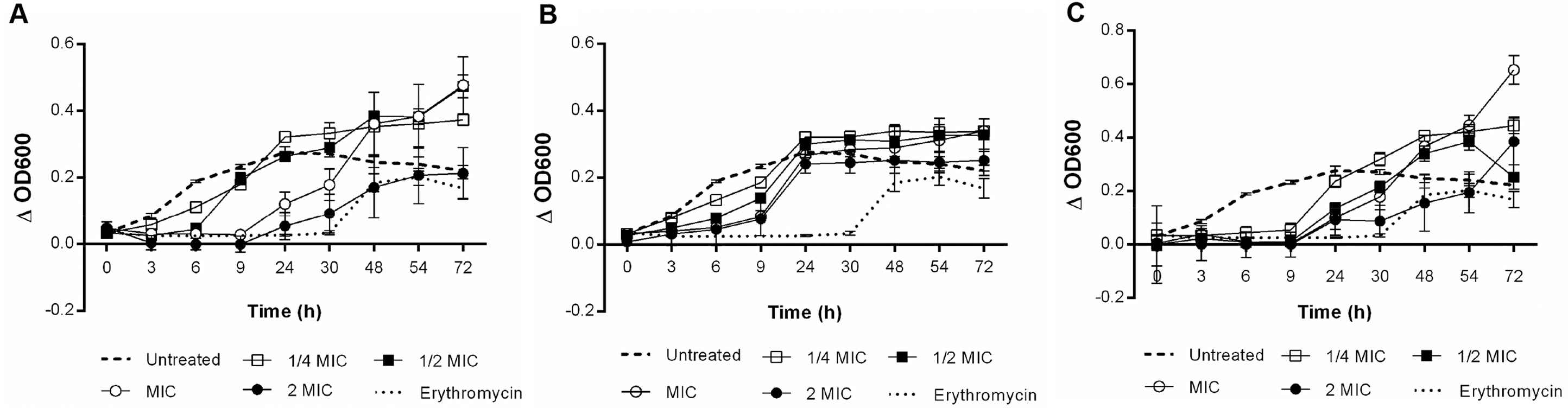
Par observation microscopique (facile et visuel), difficulté dans la réalisation de coupes suffisamment fines
- Réaliser des coupes de tige de rosier,
- Monter entre lame et lamelle dans une goutte de perchlorure de fer
- Observer au microscope, les tanins sont visibles par des « globules noirs » entre autre, dans les cellules de la moelle
Autre technique : Extraction des tanins dans un mélange hydro alcoolique
- Récupérer l’écorce d’une tige
- Faire bouillir un mélange hydro alcoolique : 6 volumes d’éthanol + 4 volumes d’eau distillée
- Mettre les écorces dans le mélange
- Laisser reposer 48 heures
- Évaporer à 40°C
Cultures de bactéries E.Coli type 1 en présence de tanins
Pour des questions de sécurité, des cultures de microorganismes réalisées au lycée ne peuvent pas être réouvertes. Articles R.1335-1 et suivants du code de la santé publique.
Respect des conditions de stérilité
Matériel
- becs électriques, eau de javel diluée, papier absorbant, savon
- poubelle de table, cristallisoir avec eau de javel
- colonies de bactéries E Coli de type 1
- tube d’eau stérile de 9 mL, écouvillon stérile
- disques papier Whatman pour antibiogramme, 6 mm Ø
- boite de pétri contenant le milieu de culture solide GN (gélose nutritive), important que ce soit ce milieu
- solution de tanin à 1% (acide tanique en poudre - soluble dans l’alcool et l’eau)
Protocole
- Ôter vos bijoux (bagues et bracelets)
- Attacher vos cheveux si nécessaire
- Laver vos mains au savon
- Nettoyer la paillasse à l’eau de javel diluée
- Allumer le bec électrique pour créer la zone de stérilité (entre deux becs électriques c’est encore plus efficace)

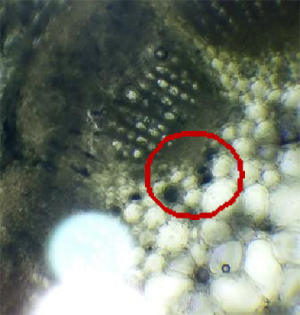
La zone de stérilité dans laquelle vous devez manipuler est définie par la zone rouge présentée sur le schéma. Veiller à ce que tout le matériel soit situé dans cette zone de stérilité.
Le matériel contaminé par des microorganismes présente un risque pour l’environnement ! Tout le matériel utilisé pour la mise en culture (écouvillon…) sera déposé dans un cristallisoir contenant de l’eau de javel.
Faire pousser bactéries n’est pas un acte dangereux, cependant, il faut savoir que le milieu utilisé et que les conditions de culture peuvent convenir à d’autres microorganismes moins sympathiques. Il est nécessaire de fermer toutes les boîtes de Pétri après ensemencement à l’aide de ruban adhésif ou bien de film étirable paraffiné.
Opérer rapidement et toujours dans la zone de stérilité du bec électrique pour restreindre les possibilités de contamination.
Étalement des bactéries
1. Tremper l’écouvillon dans la suspension, égoutter
2. Fermer le tube
3. Ouvrir le couvercle de la boîte de Pétri
4. Étaler votre prélèvement entièrement sur la gélose de la totalité de la boîte (1).
5. Tourner la boîte d’un quart de tour, étaler à nouveau entièrement (2).
6. Fermer la boîte
7. Jeter l’écouvillon dans la poubelle
Dépôt des disques
1. Faire chauffer la pince de prélèvement
2. Positionner la boîte contenant les disques dans la zone de stérilité
3. Prélever un disque et l’imbiber de solution de tanin à 1%
4. Ouvrir la boîte de Pétri et déposer le disque
5. Fermer le couvercle de la boîte de Pétri
6. Recommencer cette manipulation pour chaque disque (autre concentration 10 % et eau distillée) en les éloignant les uns des autres
7. Laisser à l’étuve 24h à 37°C, boite retournée.
Réalisation de la suspension de bactéries
La procédure décrite est destinée au personnel qui prépare la séance au laboratoire.
- Prélever, avec un écouvillon stérile, une colonie de bactéries et la diluer dans un tube d’eau distillée stérile de 9 mL
- Bien homogénéiser
Résultats
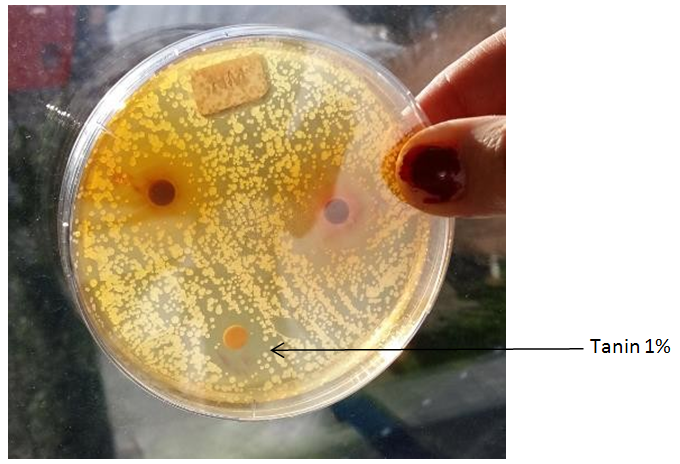
Exemple de résultat obtenu. Les disques du haut ont des concentrations plus importantes, mais la coloration très forte gène la visualisation de l’effet antibactérien.
Évaluation
Des exemples d’évaluation formative possibles pour une évaluation rapide et très fréquente sont proposés. Ces exemples doivent permettre :
- un retour immédiat d’erreur ;
- un état des acquis des élèves dans les classes antérieures ;
- un positionnement positif sur les acquis des élèves.
Règles de base à lister lors d’une discussion préalable avec les élèves sur les règles nécessaires à la réalisation d’une mise en culture :
- Désinfection matériel et surface
- Désinfection personne = lavage de main
- Ne pas éloigner le matériel de la zone de désinfection
- Ne pas parler ni se déplacer pendant la mise en culture
Les indicateurs utilisés permettent d’évaluer les niveaux de maitrise d’une compétence comme en collège, avec quatre item identiques à ceux utilisés au Diplôme National du Brevet :

Autre piste d’évaluation : utilisation en entrainements des curseurs utilisés en Évaluation Commune dans un exercice de type 2.
Les Évaluations Communes sont un contrôle en cours de formation. Il est possible d’entrainer les élèves dans de nombreuses activités, en utilisant l’un des trois curseurs institutionnels, par exemple :
On est ici à l’échelle des mises en relation : comment les informations et les connaissances sont-elles exploitées pour répondre au problème posé ?
Les connaissances ne sont pas obligatoirement des connaissances exprimées littéralement, mais ce peut être des connaissances qui ont été forcément utilisées pour comprendre et analyser un document
Sources
- Trentin et al. (2013) Tannins Possessing Bacteriostatic Effect Impair Pseudomonas aeruginosa Adhesion and Biofilm Formation. PLOS ONE 8(6) : e66257
Traditionnellement, Anadenanthera colubrina, Commiphora leptophloeos et Myracrodruon urundeuva sont utilisés par les communautés de la Caatinga brésilienne pour traiter plusieurs maladies infectieuses. La capacité d’altérer l’adhésion bactérienne représente une stratégie idéale pour lutter contre la pathogenèse bactérienne, en raison de son importance aux premiers stades du processus infectieux
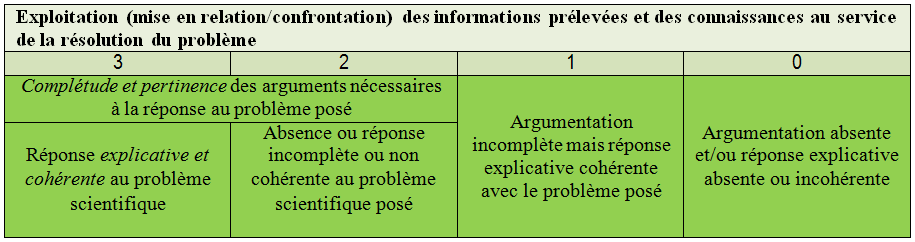
Résultats des expériences réalisées :Cinétique de l’activité antibactérienne obtenue à partir de P. aeruginosa exposée à des extraits d’écorce de tige (3 variétés), à quatre concentrations différentes (incubation à 37°C).
Dans cet ensemble d’expériences, il y a eu une diminution significative de la croissance bactérienne dans une courte période d’exposition à toutes les concentrations d’extrait (sauf pour 1 / 4xMIC d’A. Colubrina et
C. leptophloeos - Fig. 1A – B). La croissance bactérienne est restée inhibée ou faible jusqu’à 9 h après incubation. Max jusqu’à 24 h.
Autre source : de Souza Pereira et al. (2017) Commiphora leptophloeos Phytochemical and Antimicrobial Characterization. Front. Microbiol. 8:52